腐蚀不只是失效(在储能上的腐蚀应用)
腐蚀似乎总与灾难和损失联系在一起,无论是工程构件的锈蚀,还是往期推文中提及的油气管道的穿孔,这些金属结构失效原因中都有腐蚀的身影。然而,腐蚀本质上是一种可控的电化学反应,它既能带来损伤,也可以被巧妙地应用在现带工程的许多技术中,像是典型的牺牲阳极来保护阴极,这一以腐蚀来保护结构的思路,已广泛应用于船体与海上平台防护、海底管线与储罐阴极保护和桥梁支座与地下设施长期防护系统。腐蚀不仅能防护,还能加工材料——电化学加工和微电子刻蚀等技术。腐蚀在对冶金上的作用可以追溯到更早时期,铜、金、镍乃至废旧电子元件的回收,均离不开这种受控的腐蚀过程。
随着全球气候变暖和生态环境破坏不断加剧,对于开发和利用新型清洁替代能源,以及高效能源转换和存储技术,已经成为急需解决的重大突出问题。锂离子电池的枝晶问题隐患很大,同时锂资源的枯竭导致锂离子电池的价格上涨,致使需要进一步寻找安全和低成本的电池。近年来,研究人员将目光放在了金属空气电池上,这一类电池利用了在放电时阳极发生氧化反应(M→Mn++ne-),形成电子,阴极发生还原反应(O2+H2+4e-→4OH-)。由于其理论电压与比能量密度要远高于其他电池,它们的理论电压与比能量密度如表1所示,使其具有极大的发展潜力。其组成为阳极材料、空气阴极和电解质。电解质溶液大多数为碱性或者中性,甚至在镁空气电池应用中,可以采用海水,极端情况下还可以采用尿液充当电解质,这一条件就使得这一电池的使用场景大大拓宽。
表1. 不同类型金属-空气电池的理论电池电压及理论比能量密度
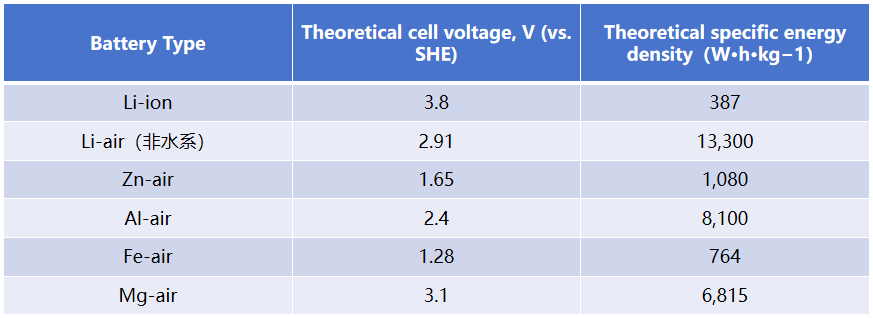
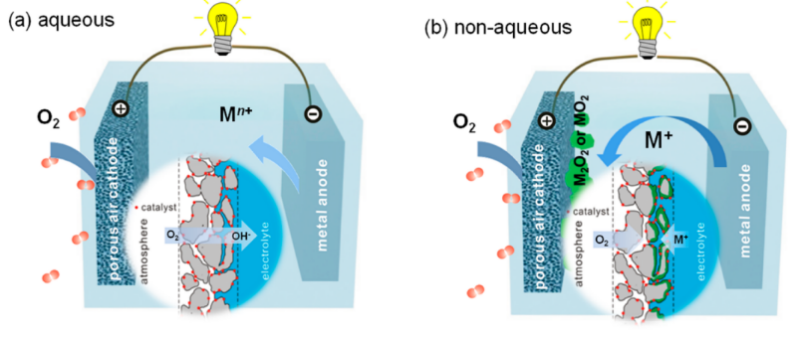
图1. (a)水系和(b)非水系金属空气电池的示意性配置和工作原理
虽然金属空气电池有着上述的诸多好处,但其氧化还原动力学缓慢,且各类金属空气电池还是有着一些自身的缺陷限制了它们的应用。由于锂等金属在水系电解液中反应过于剧烈,因此其大多使用非水系的传统有机碳酸酯电解液。而水系和非水系的电化学有很大的不同,因此将这些技术成为现实需要克服的障碍也不同。
1. 水系金属空气电池(Zn、Fe、Al、Mg):锌、铁、铝和镁等金属在水溶液体系中从热力学上是不稳定的,但在电解液中放电时,它们的表面会形成腐蚀产物,因此能够实现与水系电解液的兼容。在这类电池中,锌空气电池因具备较高的理论能量密度和电压,且能够实现可充电,同时制造成本相对低廉而受到广泛关注。它所面临的问题是能量效率较低以及循环寿命不理想(如图2),该电池仅能在小电流和短循环条件下保持可逆循环性能;在高电流下长时间循环时,ORR催化剂会受损,使CoO纳米颗粒从碳纳米管上脱落并聚集在一起。铁空气电池虽然也具备可充电特性且循环性较好,但其使用能量密度较低。铝空气电池与镁空气电池虽具极高理论能量密度,但由于金属阳极与水系电解液接触时会发生严重副反应腐蚀,实际可利用容量极低,只能通过机械更换方式实现“充电”。
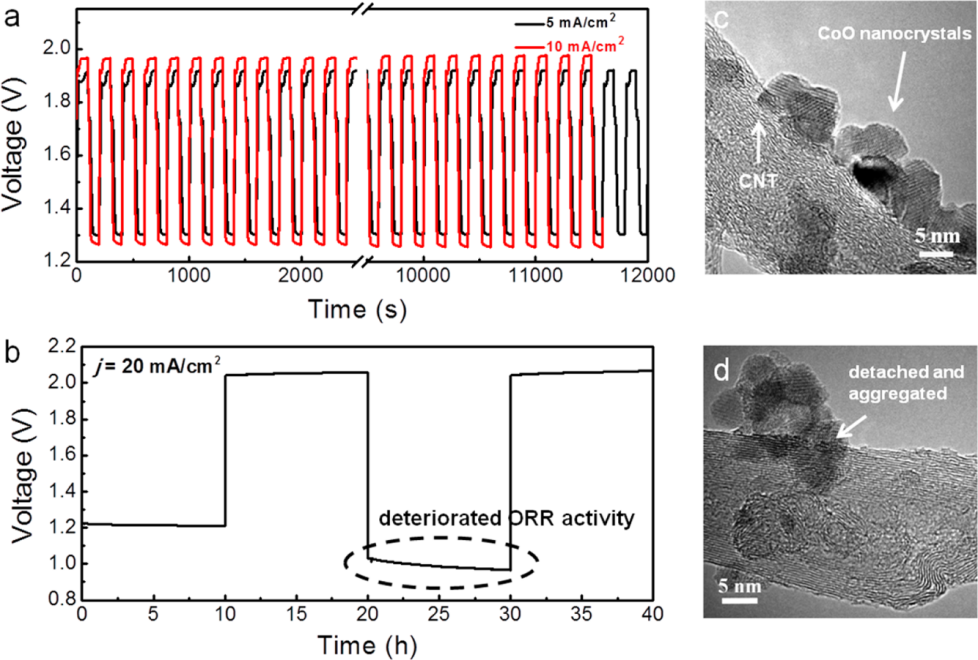
图2. 可电充电的锌空气电池
2. 非水系金属空气电池(Li):因为锂金属在水溶液中反应性极高,仅当其表面被离子导电薄膜(如NASICON型玻璃陶瓷)保护时,才能在水系电解质中稳定运行。所以目前,锂空气电池大多数采用非质子电解质,在这一体系中,它的氧化还原机理与水系体系完全不同,这个过程一开始是在催化剂表面发生一次电子的还原反应:O2+e-→O2-,随后,超氧阴离子(O2-)与碱金属离子(M+)反应生成过氧化物(MO2)。这些超氧化物或过氧化物在电解质中的溶解度较低,会沉积在空气电极上,逐渐阻塞反应活性表面,最终导致电池停滞放电。
图3. 采用Ir−rGO阴极的锂空气电池 (a) 示意图展示了 LiO2 与 Ir3Li 之间的晶格匹配关系,这种匹配可能是导致在 Ir−rGO 阴极上生成 LiO2 放电产物的原因。(b) Ir−rGO 阴极在 100 mA/g 电流密度下的电池放电电压曲线,插图显示了循环次数与容量的关系。(c) 不同放大倍数下,Ir−rGO 阴极表面放电产物的扫描电镜(SEM)图像
目前研究人员在针对上述这些问题中,提出了一系列的改善方法,对阴极与阳极材料的合理设计与工程优化,同时优化电解质和空气电极的配合,可以明显提升金属空气电池的放电效果。
虽然现阶段金属空气电池仍处于研究阶段,但其有着高性能、绿色、优良的价格比,不仅可适用于中小型便携式的移动电源这类民用市场,而且还可以用于海洋环境下的各类军用场景,是一种理想的军民两用技术,相信其一旦真正实用化,其市场前景将会非常广阔。




