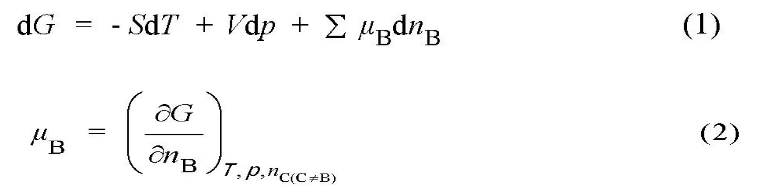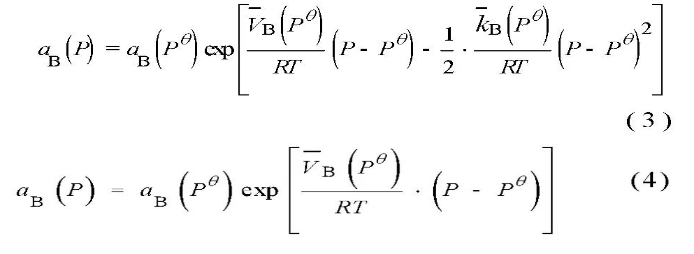在深海环境下金属材料主要受到深海静水压力、溶解氧含量、温度、含盐度、pH值、流速等诸多因素的影响[7,8]。如图1所示,随着海水深度的变化上述主要腐蚀因素均会发生相应变化。Sawant等人[9]通过研究发现不同合金在浅层及深层海洋腐蚀速率不同,合金的腐蚀速率受到了海洋中溶解氧含量的控制,低溶解氧区域钝化膜的生成及修复能力被削弱。相较于传统的铁基合金,钛及钛合金在深海环境下不易发生腐蚀[10,11]。随着海水深度增加,海水温度会随之下降,合金反应活性会下降。因此,不考虑其他变化的条件,合金的腐蚀速率会下降。但海水的含盐度约为3.5%,浅层海洋与深海之间含盐度的差异微小。但盐分离子受到海水静压作用活度增大,表现出对于钝化膜较强的攻击能力,主要通过海水溶液的比电导率以及氯离子对金属钝化膜的侵蚀来影响金属的腐蚀速率。对于pH值,浅层海水由于与空气进行对流以及植物的光合作用,通常pH值大于8,而随着深度增加,pH值下降。对于大多数金属,pH值越低,海水的腐蚀性越强[12]。
深海区别于浅层海洋的最大特点是其巨大的静水压力。范林等人[13]研究得出了随着静水压力和预应力的升高,Ni-Cr-Mo-V高强钢的腐蚀速率增大,表现在点蚀的萌生、发展和合并过程。静水压力促进了点蚀微孔的萌生和在表面的随机分布。胡裕龙等[14]研究常压至4 MPa静水压力交替变化对高强海洋用钢的腐蚀作用,得出静水压力交替作用改变了表面腐蚀产物的界面性能,从而加剧了钢的腐蚀。刘杰[8]通过模拟深海高压水环境实验装置对2种低合金钢腐蚀行为进行了研究,得到深海压力会加速低合金钢的阳极溶解速度,低合金钢由低静水压力下的均匀腐蚀转变为局部腐蚀。Beccaria等[15,16]研究了不同的深海静水压力对铝及其合金、AISI300等不锈钢腐蚀行为的影响,不同的压力会影响金属表面形成的腐蚀产物的特性从而影响金属的腐蚀速率。在深海高静水压力下,Cl-的活性较之浅海大大增加,Cl-更易渗入金属表面的钝化膜,致使钝化膜受到破坏,诱发金属产生点蚀。此外,在高静水压力下,离子水合作用困难,金属表面的离子水合物组成成分比例发生改变。因此,会影响金属表面腐蚀层的保护性能。静水压力会导致纯镍钝化膜不稳定并且活性增强,降低纯镍钝化膜形成速度,纯镍在深海环境下更容易发生腐蚀[17,18,19],此外,高静水压力会加速金属表面涂层失去保护效果,从而使合金受到腐蚀[20]。综上,可以得出静水压力通过促进点蚀萌生、降低金属表面腐蚀产物的抗腐蚀性能、加速阳极溶解速度、破坏钝化膜等一系列方式影响金属的抗腐蚀性能。马荣耀[21]从热力学及动力学过程的角度,分析了静水压力对金属、深海环境因子活度、pH值及化学平衡的影响,建立静水压力对金属腐蚀行为作用的理论基础模型。深海高静水压力会对多相合金、焊接组成的金属构件等造成区域性活度差异,不同种类的金属的活度差异则会导致其不同于无压力及低压力条件下的腐蚀行为差异出现。深海高静水压力同样会对海水中的Cl-活度造成影响。除去外在功的影响,海水的热力学基本公式如下式(1),海水中溶质组元B的化学势如下式(2)[22]:
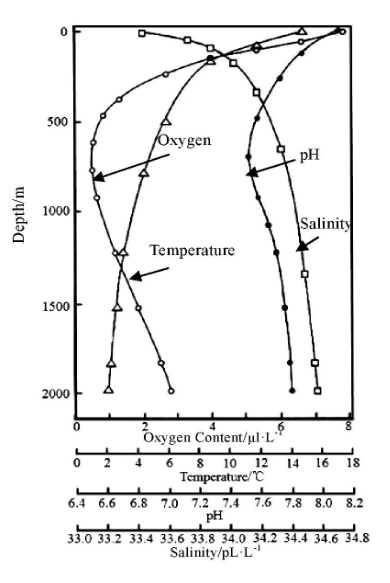
图1 海水深度与海水温度、pH值、盐度及氧含量间的关系
Fig.1 Relationship of seawater depth to temperature,pH,salinity and oxygen content[12]
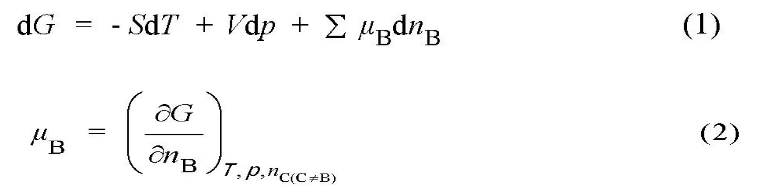
式中,S为对应体系的熵,V为对应体系的体积,G为对应体系的吉布斯自由能,nB、μB分别为B物质的量及化学势,nC指海水中其他溶质组元。
深海静水压力所能达到的数值对溶质组元的偏摩尔体积影响很小,故可以忽略其造成的影响,得到下式[21]:
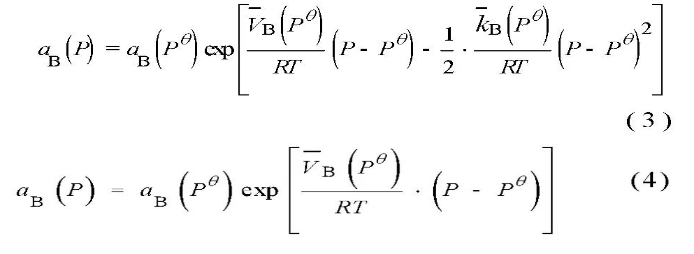
式中,P代表为体系压力,Pθ代表为标准态压力,_aB(P)及aB(Pθ)分别为B在压力P及Pθ时的活度,kB(Pθ)为B在压力Pθ时的偏摩尔压缩性,为B在压力Pθ时的偏摩尔体积,R则为气体常数,T代表温度。通过导入相关数据[23,24,25],代入上式(3)和(4),计算了不同压力下Cl-在0.725 mol/L的氯化钠溶液中的活度,结果如下图2所示[21]。可见,Cl-活度随着压力的升高而增加,呈线性上升趋势。在深海高静水压力环境下,Cl-活度较之浅海更高,Cl-更加容易渗入金属表面钝化膜,改变点蚀电位,导致金属发生点蚀,进而加快了金属的腐蚀速率及失效速率。
金属腐蚀一般是由2个主要的腐蚀过程构成,析氢腐蚀以及吸氧腐蚀。因而,研究深海高静水压力对海水中氢元素及氧元素的活度影响作用是必不可少的,静水压力、氢元素、氧元素等因素会综合影响金属的腐蚀行为。在应力作用下,氢元素会聚集在金属表面裂纹尖端的高应力区,降低金属断裂表面能,扩大金属表面裂纹,增大腐蚀速率,并且金属受到的应力越大,断裂韧性越差[26]。根据Sieverts定律[27],静水压力会影响海水中氢元素的溶解度,从而影响金属的氢致开裂程度。氢的溶解量会影响钢在深海环境中的应力腐蚀敏感性,在高静水压力下,氢浓度呈线性增加,从而促进了金属的应力腐蚀[28,29]。
实验室一般通过压力反应釜充入气体进行加压来模拟深海环境,通过Redlich-Kwong equation of state[30]一系列关系方程式及Henry定律[31]演算得到Krichevsky-Kasarnovsky方程[32]:

式中,fiµ(P)为在压力P下的i的逸度,xi则是气体的溶解度,Hi为气体的Henry系数,1PS为饱和蒸气压,为压力Pθ下无限稀释状态下的偏摩尔体积。
通过式(5),可以计算出在高压条件下,气体中组元在液体中的活度等。将溶解氧的偏摩尔体积视作常数,导入相关数据[33],通过式(4)计算得到溶解氧在不同压力下的活度如图3所示[21]。如同Cl-活度,随着静水压力的增加,氧的活度也随之增加,因而便会对金属的腐蚀起到促进作用。

图2 0.725 mol/L的NaCl溶液中Cl-活度随压力变化的趋势
Fig.2 Activity of Cl-in 0.725 mol/L NaCl solution at different pressures[21]
深海静水压力的变化会对海水的电离平衡产生影响,通过导入相关数据[23,24,25],通过计算得到下图4中电离平衡常数和离子积常数变化。随着静水压力的增大,海水电离的平衡常数及离子积常数增大,从而导致c(H+)、c(OH-)增大。因而,海水的pH值随着压力的增大而减小。对于大多数金属,pH值越小,则越容易发生腐蚀。
目前对于金属材料深海腐蚀研究的方法一般分为两类:实海暴露法和室内模拟法。实海暴露即将材料投放至需要实验深度的深海中,结果真实可靠,但是实验时间长、影响因素复杂、成本昂贵,并且无法保证实验成功,因而广泛通过室内的深海腐蚀环境模拟装置[13,17,18,19]对几个因素进行控制来模拟金属材料在深海中的腐蚀行为。模拟得出的结果具有一定的意义,但深海环境十分复杂,目前装置仍无法做到各个因素的精确控制。压缩蠕变试验装置[34]可以模拟深海高静水压力下材料的蠕变行为,通过外通海水,实现材料在海水腐蚀介质环境下的蠕变实验。

图3 溶解氧活度随压力变化的趋势图
Fig.3 Activity of dissolved oxygen at different pressures[21]
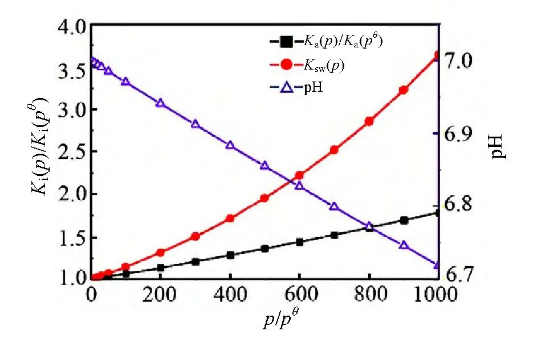
图4 不同压力下纯水电离反应的平衡常数、离子积常数及呈中性时的pH值图
Fig.4 Equilibrium constants,ion product constants,and neutral pH values for ionization reactions of pure water at different pressures[21]